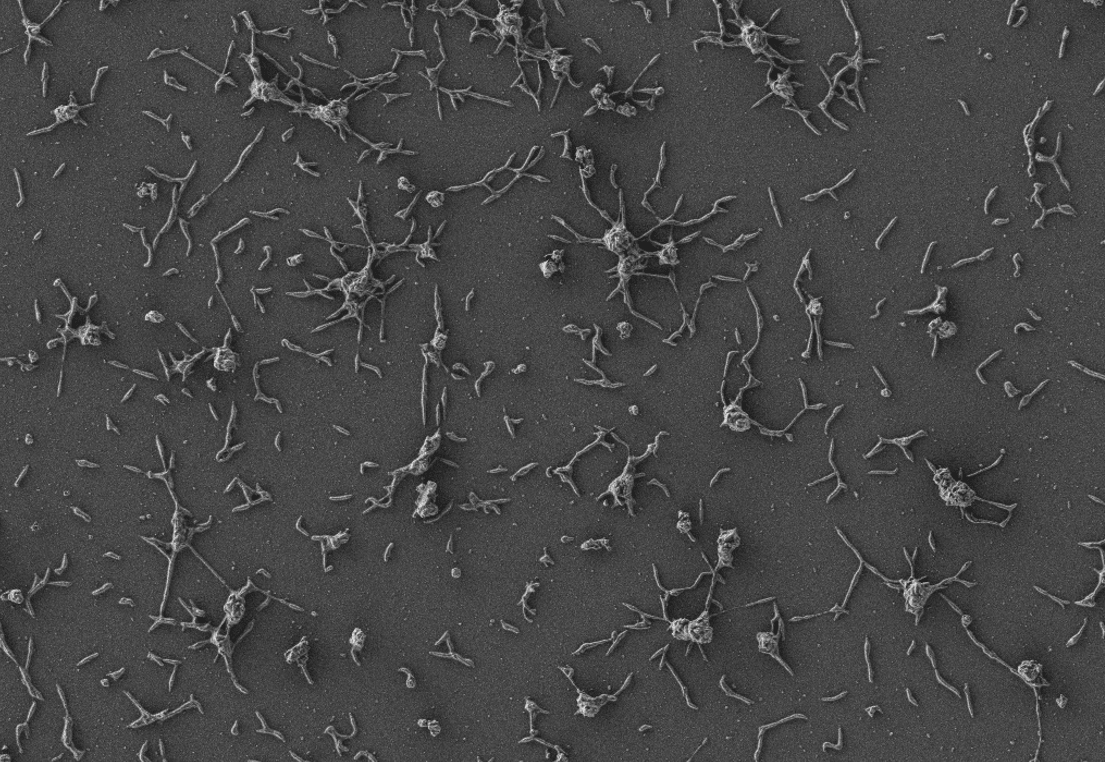
Investigadores españoles han utilizado bacterias modificadas genéticamente con la capacidad de producir enzimas que disuelven los biofilms, lo que supone un paso importante en el desarrollo de nuevos tratamientos contra las infecciones que afectan a los implantes médicos.
Un equipo del Centro de Regulación Genómica (CRG) y Pulmobiotics S.L. ha creado la primera ‘píldora viva’ para tratar bacterias resistentes a los antibióticos que se expanden en las superficies de los implantes médicos.
El tratamiento desarrollado elimina una habilidad común de estos microbios que causa la enfermedad, y la transforma para que ataque a los microorganimos perjudiciales.
La terapia experimental se probó en catéteres infectados in vitro, ex vivo e in vivo. Se trataron con éxito infecciones mediante los tres métodos de prueba. Según los autores, la inoculación de la terapia bajo la piel de los ratones acabó con estas en el 82 % de los animales tratados.
El estudio avanza en el diseño de terapias para combatir las infecciones que afectan a los implantes médicos, que son altamente resistentes a los antibióticos
Nueva terapia contra las bacterias resistentes
El nuevo método se dirige específicamente a los biofilms, las colonias de células bacterianas que se pegan sobre una superficie. Las superficies de los implantes médicos presentan las condiciones ideales para el desarrollo de estas biopelículas, donde forman estructuras impenetrables que impiden que los antibióticos o el sistema inmunitario humano destruyan los microbios allí incrustados. Las bacterias asociadas a los biofilms pueden ser mil veces más resistentes a los fármacos que las libres.
Staphylococcus aureus es una de las especies más comunes asociadas a los biofilms. Las infecciones por esta bacteria no responden a los antibióticos convencionales, y es necesario intervenir quirúrgicamente a los pacientes para extraer los implantes médicos infectados. Las terapias alternativas pasan por el uso de anticuerpos o enzimas, pero son tratamientos de amplio espectro altamente tóxicos para los tejidos y las células sanas, y causan efectos secundarios no deseados.
Los investigadores utilizaron organismos vivos que producen enzimas en las inmediaciones de los biofilms como una forma más segura y económica para tratar las infecciones
Las bacterias son un vector ideal, ya que tienen genomas pequeños que pueden modificarse mediante la simple manipulación genética.

El equipo de Pulmobiotics. Crédito: CRG
Modificación del genoma bacteriano
El equipo científico alteró genéticamente Mycoplasma pneumoniae, una especie común de bacterias que carece de pared celular. Esto permite liberar más fácilmente las moléculas terapéuticas que combaten la infección y, a la vez, evita su detección por parte del sistema inmunitario humano.
Otras ventajas de usar M. pneumoniae como vector incluyen el bajo riesgo de que desarrolle nuevas habilidades y su incapacidad de transferir sus genes modificados a otros microbios de los alrededores.
Una de las ventajas de utilizar M. pneumoniae es su incapacidad para transferir genes modificados a otros microbios
Futuras aplicaciones
El equipo tiene como primer objetivo usar las bacterias modificadas para tratar el desarrollo de biofilms alrededor de tubos endotraqueales, ya que M. pneumoniae está naturalmente adaptado al pulmón.
“Nuestra tecnología ha sido diseñada para cumplir con todos los estándares de seguridad y eficacia para su aplicación en el pulmón. Nuestro próximo reto es abordar la producción y fabricación a gran escala, y esperamos comenzar los ensayos clínicos en 2023”, declara María Lluch, coautora del estudio y directora científica de Pulmobiotics.
Una vez llegan a su destino, los vectores bacterianos ofrecen una producción continua y localizada de la molécula terapéutica
Referencia:
Garrido et al. “Engineering a genome-reduced bacterium to eliminate Staphylococcus aureus biofilms in vivo” (2021). Molecular Systems Biology. DOI:10.15252/msb.202010145