Los hospitales Clínic y Bellvitge, en Barcelona, son pioneros en utilizar este tratamiento para curar infecciones recurrentes por la bacteria C. difficile, del que se investiga su uso en enfermedades neurológicas, metabólicas e incluso cáncer. Acaban de abrir el primer banco de microbiota intestinal público de España.
“Aquella mañana me desperté con un dolor abdominal tan fuerte e intenso que pensaba que me moría”, recuerda Santiago Marco, de 52 años. En urgencias de un centro de atención primaria achacaron aquellos dolores de vientre a los problemas que los antibióticos que había tomado para tratar una neumonía suelen causar, por lo que le recomendaron “que tomara unos cuantos yogures durante unos días” y lo mandaron para casa.
Sin embargo, el malestar y la intensidad del dolor que sentía Marco eran tales que decidió acudir a un hospital. Y allí, ¡bingo! Un test de antígenos reveló que sufría una infección por Clostridioides difficile, una bacteria patógena, por lo que lo ingresaron durante 10 días y le administraron antibióticos. De vuelta a casa, tras dos semanas de tregua, los síntomas reaparecieron. En el hospital, de nuevo, “me dijeron que sufría una recidiva: la infección se había reproducido y debía ingresar otra vez y tomar antibióticos aún más potentes”, explica este físico investigador Instituto de Bioingeniería de Catalunya (IBEC) a SINC.
Su curiosidad científica le llevó entonces a indagar sobre C. difficile; fue así como descubrió que a partir de la tercera recaída ya no se podría curar la infección, por lo que debería tomar antibióticos de por vida, con la consiguiente degradación de salud que eso le supondría. Marco también halló que se habían llevado a cabo ensayos clínicos en Estados Unidos usando trasplante de microbiota fecal, un tratamiento que obtenía unas tasas de éxito del 90% en pacientes en una segunda recaída.

Me programaron una colonoscopia [en el Hospital de Bellvitge] y me practicaron un trasplante de microbiota fecal. Aquello fue mano de santo. Salí de allí y nunca más he tenido una reinfección por ‘C. difficile’


Las muestras se procesa en fresco y se guarda una alicota, para asegurar la trazabilidad de todos los trasplantes fecales. / Hospital Clinic
De la ‘sopa amarilla’ a los trasplantes fecales
Entre un 1 y un 3% de la población general sana es portada en sus intestinos de Clostridioides difficile; solo en un porcentaje reducido de personas acaba generando problemas de salud e incluso, en los casos más extremos, sepsis y la muerte. Se estima que cada año en España unos 7600 individuos sufren una infección por este microorganismo, la mayoría suelen ser de edad avanzada, con un sistema inmunitario comprometido, que previamente suelen haberse sometido a un tratamiento con antibióticos.
Paradójicamente, las infecciones recurrentes por C. difficile se trata con estos potentes fármacos que, de hecho, arrasan con la gran mayoría de bacterias, la llamada microbiota intestinal del colon, lo que, a su vez, provoca que entre el 20 y el 30% de los pacientes recaigan y deban volver a tomarlos. Y una vez se produce una recidiva, el riesgo de que se repita es muy elevado.
Las infecciones recurrentes por ‘C. difficile’ se trata con antibióticos que arrasan con la gran mayoría de bacterias, la llamada microbiota intestinal
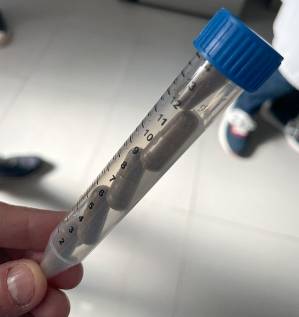
En el hospital de Bellvitge realizan el trasplante de microbiota fecal mediante cápsulas liofilizadas, algo mucho menos invasivo que la colonoscopia. / Cristina Sáez
No obstante, cuando se produce un desequilibrio en su composición, como ocurre tras tomar antibióticos, esa población de microorganismos merma y los patógenos pueden proliferar a sus anchas. “Es como tener una habitación abarrotada de personas: por mucho que quiera entrar otro grupo de individuos, no podrá porque no hay espacio. En cambio, si la habitación está medio vacía, lo tienen fácil para comenzar a ocuparla”, afirma Guardiola.
En este sentido, el trasplante fecal contribuye a repoblar esa habitación para dejar sin espacio a los patógenos. Consiste en obtener microbiota intestinal a partir de una muestra de heces de un donante sano e inserirla en el colon de un paciente que sufre un desequilibrio en su propia microbiota. En la mayoría de los casos se realiza a través de una colonoscopia, aunque cada vez más se investiga con cápsulas, un procedimiento que a pesar de que es algo menos eficaz -un 90% en el caso de la colonoscopia, frente a cerca del 80% en el de las pastillas-, resulta menos invasivo para el paciente.
El trasplante consiste en obtener microbiota intestinal a partir de una muestra de heces de un donante sano e inserirla en el colon de un paciente que sufre un desequilibrio en su propia microbiota
El primer banco público
Bellvitge fue junto al Hospital Clínico de Barcelona uno de los centros pioneros en España en comenzar a aplicar este tratamiento en 2018, luego les siguieron el Gregorio Marañón y el Ramón y Cajal. Por el momento, el trasplante de microbiota fecal (TMF) solo está aprobado a escala internacional para tratar las infecciones recurrentes por C difficile.
Sin embargo, numerosos ensayos clínicos en todo el mundo estudian ahora aplicarlo en enfermedad inflamatoria intestinal, obesidad, diabetes, alzhéimer y otras enfermedades neurológicas. Incluso se investiga aplicarlo al cáncer
Numerosos ensayos clínicos en el mundo estudian ahora aplicar este trasplante a la enfermedad inflamatoria intestinal, obesidad, diabetes, alzhéimer y otras dolencias neurológicas. Incluso se investiga aplicarlo al cáncer
Asimismo, a finales de 2023, los dos hospitales catalanes se aliaron y crearon el Banco de Microbiota de Catalunya, el primero que existe en España y que es público, amparado por la administración catalana, “porque queríamos que todos los ciudadanos pudieran tener acceso a estos tratamientos”, apuntan, y uno de los pocos que hay de momento en Europa.
En las dos sedes del banco, en Bellvitge y en el Clínic, se procesan las muestras de donaciones que les llegan a diario de donantes previamente seleccionados. En el laboratorio las procesan, las centrifugan y las congelan a -80ºC durante dos meses en cuarentena. Pasado ese tiempo se realiza un nuevo cribado del donante y si todo es correcto, las muestras se liberan y se consideran aptas para trasplantar.

Con la trazabilidad, si aparece alguna enfermedad en el receptor en el futuro, podemos ir a ver qué ha pasado en el donante y si la microbiota estaba o no implicada


Cultivos de bacterias procedentes de las heces de un donante. / Cristina Sáez / SINC
“Estoy súper sano”
El proceso de selección de donantes, muy estricto, es una de las claves de éxito del Banco de Microbiota Fecal de Catalunya. La enfermera del Clínico Mireia Ruíz explica que la captación del donante empieza en el Banco de Sangre y Tejidos cuando van a donar sangre al hospital. Deben tener entre 18 y 50 años y unos hábitos de vida saludables, con un historial clínico sin ninguna enfermedad que lo excluya del proceso. Pasan un par de cuestionarios muy exhaustivos, análisis de sangre y heces, y una revisión médica. “Solo aproximadamente entre un 4 % o un 5% de los potenciales donantes acaban siendo aptos”, señala Ruiz.
Solo aproximadamente entre un 4 % o un 5% de los potenciales donantes acaban siendo aptos
“Una de las cosas que agradecen mucho los donantes es que cada vez que utilizamos sus heces, les mandamos un mensajito con el que les informamos si las hemos enviado a otro hospital o si han servido para un tratamiento. Les hace sentir bien saber que han ayudado”, explica Montse Claparols, responsable de la captación de donantes de heces en la Unidad de Donación de Sangre del Hospital Clínic.
En el Clínic obtienen unas 230 dosis de microbiota cada año, y otras tantas en Bellvitge, lo que permite por el momento tratar en Catalunya a unas 450 personas con C. difficile, una cifra muy por debajo de las alrededor de 1600 que padecen una infección por esta bacteria anualmente.
Crucial en la medicina de precisión
Disponer de un banco público de microbiota, además, abre la puerta a la investigación. “Si dentro de unos años se descubre, por ejemplo, que una combinación de bacterias puede predecir si una persona desarrollará una patología concreta, podríamos testar a los donantes y a los receptores y realizar intervenciones tempranas”, considera Aira, para quien la medicina de precisión del futuro pasará indefectiblemente por la microbiota intestinal.
“El TMF será una herramienta crucial”, añade. En un futuro cercano, “se aplicará en oncología, para mejorar la respuesta de tratamientos con inmunoterapia; o para tratar gérmenes multirresistentes; o evitar el rechazo tras un trasplante de médula”, apunta. Y Guardiola destaca que “disponer de un banco de microbiota puede hacer de palanca para nuevas investigaciones. Esto es una revolución que no ha hecho más que empezar”.
